腹部主動脈瘤的成因是腹部動脈血管肌肉層細胞退化造成管壁彈性疲乏,使得血管像氣球般向外鼓漲,病情嚴重時易導致血管撐破並造成患者腹內大出血,即使緊急手術,死亡率仍高達五成。通常腹部主動脈血管瘤好發於六十歲以上之高齡病患,男性的罹患機率是女性的四倍,其中高血壓、糖尿病及抽菸者尤其常見,當患者主動脈管瘤直徑達到四至六公分時,則有隨時破裂大出血的危險。傳統外科治療腹部主動脈瘤雖然成功率可達九成,但病患必須接受深度麻醉及大型剖腹手術,手術時間長,併發症多,且由於傷口疼痛及排氣不順等因素,使其恢復緩慢,尤其是高齡或患有慢性肺部疾病、氣喘及心臟功能不佳的高危險群患者,對於傳統手術倂發症的風險亦相對提高。甚至因為其他臟器功能不全而無法接受傳統手術的治療。
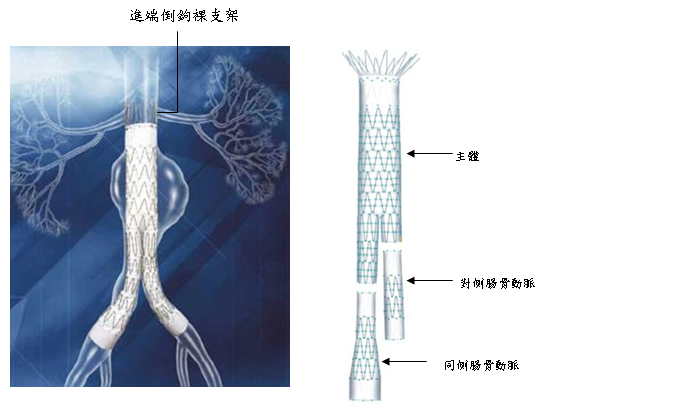
圖三:三段式腹主動脈支架血管
不過該技術應用過程中仍舊必需強調下列幾點:
1.重視手術適應症的篩選:(1)動脈瘤上緣與下方腎動脈的距離應大於15 mm,且有良好的解剖結構形態。目的在於支架上端與近端頸部血管能完全契合,以防止內滲漏和支架位移等併發症的發生。(2)動脈瘤同時侵犯至雙側內腸骨動脈時應慎重考慮是否接受血管腔內治療。腹主動脈瘤血管腔內內套膜支架治療要求術後必須保證至少一側內腸骨動脈通暢,以確保直腸及尾骶骨部血液供應。如支架置入後無法保證至少一側內腸骨動脈通暢,則不適合接受血管腔內治療。當術前手術規劃必須以支架血管同時覆蓋兩側內腸骨動脈時,則必需同時進行一側內腸骨動脈繞道手術。(3)當結腸血液供應必須依賴下腸系膜動脈時,不宜進行血管腔內治療,因為術後乙狀結腸僅能經由上腸系膜動脈和腸骨內動脈的側支循環將造成供血不足。(4)嚴重的腸骨或股動脈狹窄、彎曲可能阻礙輸送器的通過,因此不宜採用該技術治療。
2.術前評估注意事項:(1)術前評估手段以CTA、MRA及DSA為宜,3種檢查各有其優缺點〔5,6〕。(2)選取血管支架以血管外徑為測量為基準。重要測量部位包括:支架近、遠端介面處主動脈外徑;總腸骨、外腸骨動脈外徑。如動脈瘤侵犯至外腸骨動脈應注意測量腸骨動脈擴張部分最小外徑,以作為選擇腸骨動脈支架血管分體直徑的重要參數。(3)因動脈瘤的彎曲變形使長度測量較難準確,血管造影時應用帶標記的造影導管測量更接近實際情況。(4)注意觀察血管彎曲角度。動脈瘤近端彎曲角度不利於內套膜支架的固定,腸骨、股動脈的嚴重彎曲使輸送器無法通過。(5)注意血管內鈣化斑塊。老年腹主動脈瘤及腸骨、股動脈鈣化嚴重,如鈣化發生在支架結合部可能引起內滲漏,若發生在腸骨、股動脈則同樣阻礙輸送器通過。故旋轉CT最大密度投影(MIF)圖像對觀察血管內鈣化將具有重要意義。(6)內套膜支架選擇:直徑應較實際血管內徑大15%~20%,長度視具體情況而定。目前一些產品可根據動脈瘤解剖構造及測量資料購置內套膜支架,因此將更有利於血管腔內治療的進行。
3.術中注意事項:(1)內套膜支架的腔內定位,主要包括腎動脈及腸骨動脈開口的定位,應確保支架不阻塞上述動脈。定位方法包括骨骼標誌、置放帶標記的造影導管、體外放置標誌物、重複造影證實等。(2)支架主體與分體在血管內的對接是手術最困難的部份,經不同途徑達到導管穿入主體支架短臂的目的是完成支架對接的最佳保證。(3)一些狹窄性病變可先行汽球擴張血管成形,使輸送器能夠通過。(4)腸、股動脈彎曲時可應用超強導絲或牽拉股動脈,有利於支架放置。
4.併發症的防治:(1)內滲漏:是血管腔內手術的主要併發症。文獻報導最高可達30%~45%〔7,8〕。我們自己的初期結果資料內滲漏率為 8 %。內滲漏主要分4種類型:第Ⅰ型內滲漏是指滲漏部位在支架-血管,多數與介面部位血管內壁鈣化、彎曲、支架直徑選擇不當有關,因此支架釋放時介面部位應儘量避開動脈鈣化斑塊,一旦發生第Ⅰ型內漏可通過汽球囊擴張、附加支架等方法治療。第Ⅱ型內漏是指來源於動脈瘤分支血管如腰椎動脈、下腸系膜動脈的血液迴流。支架安裝前發現動脈瘤有粗大且通暢的分支血管時可先進行栓塞。一般第Ⅱ型內漏量少,常可自行癒合,當術後追蹤12個月後仍現無法自愈的第Ⅱ型內滲漏時可考慮造影下進行栓塞治療。第Ⅲ型內滲漏是指來自內套膜支架的滲漏,該類型內滲漏一般不需特殊處理。第ⅠV型:支架-支架相接合介面滲漏(2)下半身癱瘓:因支架的置入阻塞脊髓重要供血血管(脊髓根大動脈)可能導致癱瘓。該動脈一般起源於8~12胸椎的肋間動脈,但發生變異者最高可達第五胸椎,最低可達第二腰椎。文獻報導腎動脈以下腰椎動脈完全結紮發生癱瘓可能性小於1%〔9〕。對於腔內內套膜支架手術是否會引起癱瘓術前很難評估,主要因為脊髓根大動脈的起源部位術前很難確定。對容易發生癱瘓部位的動脈瘤(如:胸椎8~12區間的降主動脈瘤),國外經驗是先在動脈瘤腔內釋放可回收的內套膜支架,然後監測脊髓感覺及動作誘發電位,如果誘發電位不發生變化,可將支架更換為永久性內套膜支架,反之說明不適合腔內內套膜支架治療。(3)栓塞:栓子來源於動脈瘤附壁血栓、動脈硬化斑塊、操作過程中形成的血栓。栓塞部位可發生在腎動脈、腸骨內外動脈及股動脈遠側動脈。預防血栓形成除熟練輕柔的操作外,應在操作時阻斷股動脈血流,操作完成後釋放少量可能含有栓子的血液。(4)腸缺血壞死:因支架置入影響結腸供血所致。術後可出現血便、腸穿孔等,應及時診斷並可能切除部分結腸。該手術還可能導致動脈瘤破裂、支架移位、支架血栓形成、感染等少見併發症。我們自己的初期結果無第Ⅰ型內漏血發生且無癱瘓、栓塞、腸缺血壞死等後遺症、亦無動脈瘤破裂、支架移位、支架血栓形成、感染等少見併發症。
儘管血管腔內內套膜支架手術具有微創、可行、可靠的優點,但其最大缺點是價格昂貴,限制了該項技術的廣泛開展。此外,動脈瘤腔內內套膜支架是血管外科新興技術,雖然初期結果斐然,但是仍然必須嚴格控制手術適應症、並具備成熟的血管腔內操作之技術,且隨時可由術中轉成開腹手術的條件下進行,尤其更需長期追蹤其治療成效。
根據2004至2005年歐美兩大重要動脈瘤治療方式,採隨機之臨床研究方式(the Dutch Randomized Endovascular Aneurysm Management (DREAM) trial and the Endovascular Aneurysm Repair Trial-1 (EVAR-1)),
6,7顯示手術死亡率由4.6-4.7 %降至 1.7-1.2%。雖然血管腔內內套膜支架手術
應用於胸主動脈瘤之長期結果未明(因追蹤時間不夠),
所以目前較傾向建議適用於年老病患或不適合傳統手術者
。但可預期地,隨著手術技術及支架血管材質的進步,手術死亡率將降至低於傳統手術的三分之一以下。內套膜支架手術將成為主動脈瘤最主要的治療方式。
慢性胸主動脈剝離及胸主動脈瘤血管腔內內套膜支架微創治療
胸主動脈剝離動脈瘤並不是胸主動脈的惡性或良性腫瘤,而是胸主動脈壁在遭到動脈硬化等病理因素破壞後,高速、高壓的主動脈血流將其內膜撕裂,使主動脈的內膜和外膜分離,形成夾層,並導致破裂口附近胸主動脈擴張而形成動脈瘤。其危害是胸主動脈壁外膜發生瘤樣擴張,並隨時可能破裂而導致患者大量出血,迅速死亡。常見的引起胸主動脈剝離動脈瘤的原因有:主動脈肌膜的退行性變化、高血壓、動脈硬化、醫源性損傷、炎症、遺傳性疾病(如馬凡氏症候群)及梅毒等。
胸主動脈剝離動脈瘤的發病率並不低,在美國約為為每年約有萬分之ㄧ的患者發病,在我國發病率亦逐年升高。胸主動脈剝離動脈瘤根據病變侵犯部位不同而區分為A型和B型,前者指剝離侵犯至升主動脈;後者指主動脈內膜破裂口位於左鎖骨下動脈以降,且剝離僅侵犯至降主動脈。侵犯至升主動脈的剝離動脈瘤約占10%,侵犯至降主動脈者約占90%。由於胸主動脈剝離動脈瘤的破裂會導致患者迅速死亡,就像體內的一枚定時炸彈,因此一經確診,即應治療。傳統的治療方法是開胸行主動脈人工血管置換術,手術方式根據剝離主動脈瘤侵犯部位的不同而略有不同。由於開胸行主動脈置換術有創傷大、併發症率、死亡率高等缺點,故往往使醫病雙方均陷入進退維谷的尷尬地。
因為胸主動脈剝離動脈瘤是胸主動脈的內膜撕裂和外膜擴張而非腫瘤,其治療的目的是預防破裂而不是切除病變組織,所以只要使用人工血管將高速高壓的胸主動脈血流與病變的血管壁隔開,使血流不再經內膜破口進入夾層來衝擊已擴張的胸主動脈外膜,就可以預防其破裂,達到治癒。主動脈瘤內套膜支架治療法就是將與病變段胸主動脈相合的記憶合金支架血管預置於導管內,在X-光透試視、監視下經股動脈導入,當內套膜支架血管到達病變胸主動脈部位後,再將支架血管從導管內釋放,其記憶合金支架在血液37℃溫度的影響下將恢復至原來管徑,而人工血管便會撐開且固定於病變胸主動脈兩端的正常主動脈上,血流即從支架血管腔內流過,胸主動脈剝離動脈瘤的內膜破口及瘤樣擴張即被阻絕。內套膜支架治療法適用於B型主動脈剝離動脈瘤,只要剝離內膜破裂口距離鎖骨下動脈開口處有1.5cm以上的安全距離,人工血管近端能固定於內膜破裂口以上而又不阻塞左鎖骨下動脈即可。也就是說約有90%的主動脈剝離動脈瘤可經由內套膜支架治療法治癒,與傳統的開胸巨創手術相比,內套膜支架治療法最突出的特點是「微創」,手術僅需在大腿鼠蹊部作一個3cm長的小切口即可完成。患者不但術後恢復快,併發症率、死亡率低,並且使許多因高齡,多合併疾病而不能承受傳統手術的患者獲得了治療的機會。因此,這項「微創」新技術亦被稱為是主動脈瘤治療史上的一場革命。
所以內套膜支架治療法已成為未來治療胸、腹主動脈瘤的一項「有效」、「簡捷」而又「微創」的常規新技術。國內由於法規限制直至去年十月二十五日內套膜支架治療法才正式開放為治療胸主動脈瘤的常規手術,而本院心臟血管外科亦努力達成至今近三十二例連續成功的內套膜支架治療胸主動脈瘤的臨床經驗,無論是病歷數目或手術經驗皆居於台灣各醫學中心領先地位。
胸主動脈剝離動脈瘤的微創治療
胸主動脈剝離動脈瘤的治療一直是血管外科最富挑戰性的領域,傳統治療方法是根據胸主動脈剝離動脈瘤的分型、分期及合併症分別選擇胸主動脈重建術和藥物控制性降壓,然而兩種方法均有很高的死亡率。[8]其實早在20世紀30年代,就已經開始了血管腔內治療胸主動脈剝離動脈瘤的探索,Gurin等嘗試用剝離分隔內膜開窗手術治療,但患者死於術後腎衰竭而失敗。自從1991年,Parodi以血管腔內內套膜支架手術治療腹主動脈瘤獲得成功,自此啟動了血管腔內內套膜支架手術治療胸主動脈剝離動脈瘤的研究。與傳統的開胸手術相比,血管腔內內套膜支架手術治療胸主動脈剝離動脈瘤具有簡捷、微創、安全、有效的優點.
胸主動脈瘤腔內內套膜支架技術 (圖四)
真性胸主動脈瘤內套膜支架主要分為兩段式,固定原理主要有三原則
(一)頭段之近端及尾段之遠端的倒鉤固定於主動脈瘤兩端健康之主動脈壁。
(二) 選取內套膜支架直徑10-20%大於兩端健康之主動脈直徑,擠壓固定。
(三) 兩端健康之主動脈長度最好大於兩公分。若近端若不足兩公分以上支架置入安全距離,支架必須前進故將遮住主動脈弓重要分支,則必須合併頚部或胸部繞道手術。同理若遠端遮住腹腔重要分支則須則須合併腹部血管繞道手術。(圖五)
僅守此三原則則長期效果佳,內滲漏及位移之機率可減少至最低。
至於針對剝離性動脈瘤手術目標為置入於真腔並封住內膜破洞口,故常僅使用一至二段之頭段內套膜支架即可。固定原理靠進端倒鉤及真腔之擠壓固定於健康之主動脈。
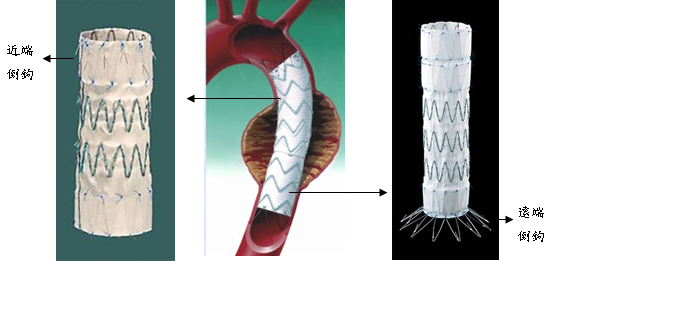
圖四:兩段式胸主動脈支架血管
圖五: 合併傳統血管繞道手術。細箭頭:傳統升主動脈至主動脈弓分支血管繞道手術。粗箭頭:內套膜支架血管一、胸主動脈剝離動脈瘤血管腔內內套膜支架手術的理論基礎
自從Debakey、Cooley等於1955年成功地以人工血管置換手術治療胸主動脈剝離動脈瘤以來,直至90年代初期該手術方式一直是治療胸主動脈剝離動脈瘤的唯一的有效方法,他們所建議的治療原則至今仍然為外科醫師奉為規臬[9,10].這些原則包括:
1、 剝離動脈瘤近端包括內膜破裂口的主動脈段切除。
2、 恢復剝離遠端真腔供血。
3、 剝離的分隔內膜縫合固定回外膜等。
因為胸主動脈剝離動脈瘤是動脈壁的薄弱擴張而非腫瘤,所以只要能預防動脈瘤破裂和治療剝離分隔內膜引起的併發症即達到了治癒的目的。Debakey、Cooley等學者提出上述原則主要是為了達到兩個目的:
1、 預防胸主動脈血流持續經剝離內膜破裂口進入剝離動脈瘤假腔導致病變擴張的主動脈壁破裂。
2、 預防和治療剝離分隔內膜阻塞主動脈的分支動脈開口所引起肢體或臟器缺血。
動脈瘤血管腔內內套膜手術的原理是將支架血管經遠端股動脈導入,利用支架的彈性擴張將人工血管無需縫合固定於病變動脈兩端的正常動脈壁,使高速、高壓的動脈血流與擴張薄弱的動脈瘤壁隔絕,而達到預防動脈瘤破裂的目的。使用血管腔內內套膜手術治療胸主動脈剝離動脈瘤時,要確保植入物經剝離動脈瘤真腔導入,釋放後完全封閉內膜破裂口,使主動脈血流不再進入剝離假腔而只能經支架血管流入剝離的遠端真腔,而剝離假腔內血液則逐漸形成血栓,血栓硬化後使主動脈壁結構增強。這樣就在預防動脈瘤破裂的同時恢復了夾層遠端真腔供血。因此,血管腔內內套膜手術治療胸主動脈剝離動脈瘤完全可以達到胸主動脈重建術的治療效果,符合Debakey、Cooley等學者提出的手術治療原則。
二、胸主動脈剝離動脈瘤血管腔內內套膜手術的適應症
血管腔內內套膜手術要求動脈瘤有合適植入物固定的動脈瘤頸,隔絕的動脈段無重要的分支。因此,根據胸主動脈剝離動脈瘤的Stanford分型, B型胸主動脈剝離動脈瘤只要動脈瘤頸長度大於1.5cm,即完全適合以腔內內套膜手術治療。在傳統的開胸主動脈重建術時代,Crawford 等提出Stanford B型胸主動脈剝離動脈瘤的手術適應症是[11,12]:急性期藥物控制血壓療效不佳或合併分支血管阻塞,慢性期剝離動脈瘤直徑大於5cm或直徑增加大於1cm/年。腔內內套膜手術的出現使慢性期Stanford B型胸主動脈剝離動脈瘤的手術適應症有所改變,以往提出的手術適應症是動脈瘤破裂機率與手術危險性提出的權衡結論,其實胸主動脈剝離動脈瘤並不會自愈,手術是唯一有效治療方法,而血管腔內內套膜手術較安全、且微創,所以只要確定Stanford B型胸主動脈剝離動脈瘤的診斷,且剝離內膜破裂口距左鎖骨下動脈開口2 cm以上,植入物能夠固定,即適合接受腔內隔絕術。近端若不足2 cm以上支架置入安全距離,將遮住主動脈弓重要分支,則必須合併頚部或胸部繞道手術。遠端則須則須合併腹部血管繞道手術。
對於慢性期胸主動脈剝離動脈瘤血管腔內內套膜手術的手術適應症,專家間觀點較一致,而且臨床上也都呈現不錯的治療效果。目前針對血管腔內內套膜手術治療胸主動脈剝離動脈瘤的手術適應症的爭論主要在於:
急性期Stanford B型胸主動脈剝離動脈瘤的血管腔內內套膜手術治療[13-15]:
在開胸主動脈重建術時代,因急性期剝離主動脈壁發炎水腫明顯,縫合困難,且Stanford B型胸主動脈剝離動脈瘤只要控制好血壓且無嚴重缺血併發症,在急性期的死亡率並不高。因此多數作者均不主張急性期或亞急性期時執行手術。近期開始有作者報導血管腔內內套膜手術治療急性期及亞急性期Stanford B型胸主動脈剝離動脈瘤,短期效果良好,但因病例數較小,與慢性期的治療效果尚缺乏大樣本的比較研究。
2、 Stanford A型胸主動脈剝離動脈瘤的腔內隔絕術治療[13-15]:
A型胸主動脈剝離動脈瘤除了在急性期破裂率高外,還可因心包填塞、主動脈瓣逆流、心律不整等併發症導致患者死亡,一般主張急性期行升主動脈置換術。近期血管腔內內套膜手術向這一領域的拓展可分為兩個方向:一是用於治療剝離內膜破裂口在降主動脈的逆行撕裂至升主動脈和主動脈弓的A型胸主動脈剝離動脈瘤,治療方法同B型;二是在開胸行主動脈弓置換術治療侵犯至降主動脈的A型胸主動脈剝離動脈瘤時,經主動脈弓的遠端切口向降主動脈內植入腔內內套膜支架植入物,以增強主動脈弓置換術的效果,類似於傳統手術中的象鼻技術。這兩種方法均僅見零星個案報導,短期療效較好,可能是血管腔內內套膜手術治療胸主動脈剝離動脈瘤的發展方向有關。
三、B型胸主動脈剝離動脈瘤血管腔內內套膜手術操作技術的發展
B型胸主動脈剝離動脈瘤腔血管腔內內套膜手術的關鍵點是準確定位剝離內膜開口和正確判斷剝離真、假腔。因此我們將採用經左肱動脈插管造影法,操作步驟為:在DSA監視下,患者全身麻醉後,採平躺臥位,消毒雙側腹股溝區及左上肢。以Seldinger方法穿刺左肘肱動脈,沿導絲插入5F導管鞘,撤出導絲,從導管鞘旁路注入肝素溶液,預防血栓形成。經左肘動脈穿刺導鞘送入導絲至升主動脈,沿導絲送入pig-tail 導管,將導管定位于左鎖骨下動脈開口,撤出導絲,行胸主動脈造影。DSA顯示剝離真腔迅速顯影,假腔顯影速度慢且造影劑濃度低,動態觀察下,可見血流經內膜破口進入假腔。這種方法完全避免了造影導管置入剝離假腔的可能,並且可以在DSA監視器上標記夾層內膜破口以及經左肱動脈導管再次置入導絲標記左鎖骨下動脈開口。
對於動脈瘤頸長度小於2 cm以上的胸主動脈剝離動脈瘤,可將腔內內套膜支架植入物近端放置於左頸總動脈開口於左鎖骨下動脈開口之間。解剖學研究發現,成人這兩條血管開口之間的距離約為1~1.5cm,可滿足內套膜支架植入物近端固定的需要。具體方法有兩種:(1)在全身麻醉後先行左鎖骨下動脈與左頸總動脈端側吻合術,將左鎖骨下動脈開口縫合於左頸總動脈,然後行主動脈剝離腔內隔絕術,術中內套膜支架可安全地超過左鎖骨下動脈開口固定;(2)先行主動脈剝離腔內隔絕術,內套膜支架近端遮蔽左鎖骨下動脈開口,然後在同次麻醉下行左頸總動脈與左鎖骨下動脈人工血管繞道手術,亦有作者主張腔內隔絕術後根據患者臨床表現再決定是否行左頸總動脈與左鎖骨下動脈人工血管繞道手術,其理論根據為結紮左鎖骨下動脈後左上肢的壞死率只有15%.
對於導入動脈狹窄的患者,可採用以下方法:(1)先用氣球進行擴張,以檢測狹窄的可擴張性,並為其後安全導入導絲和導管開闢通路:(2)在下腹部作斜切口,經腹膜後腔顯露總腸骨動脈,經總腸骨動脈導入導絲和導管,即使需要經遠端腹主動脈導入導絲和導管,其創傷仍遠小於胸主動脈重建術。
對於動脈瘤頸直徑過大(>40mm)的患者,在內套膜支架植入物釋放過程中,植入物近端容易扭曲、反折,導致近端內滲漏。為避免此併發症,可選用有單側連續支撐的內套膜支架,在植入物釋放過程中,控制性降壓至收縮壓80mmHg左右,以減小血流衝擊力,部分作者甚至採用了釋放植入物的瞬間使心臟停跳的方法來保證內套膜支架的準確定位。
四、胸主動脈剝離動脈瘤腔內內套膜支架手術的問題及不足
1、 內套膜支架術後內滲漏:
內滲漏是動脈瘤腔內內套膜支架手術後出現的新概念,特指內套膜支架手術後,動脈瘤腔內仍有血流進入,持續存在的內滲漏可導致胸主動脈剝離動脈瘤繼續增大直至破裂。內滲漏產生的原因有兩種:(1)來源於內套膜支架植入物與動脈瘤頸之間(稱為第I型內滲漏),可因動脈瘤頸有嚴重鈣化、內套膜支架植入物口徑過小等造成,多數可在術中移植物釋放後再次造影時發現。少量內滲漏可隨後追蹤觀察至術後6個月,大部分可以自行癒合關閉;大量內滲漏必須術中立即處理,可經股動脈再次導入另一較大口徑腔內內套膜支架植入物,固定於前一植入物近端或遠端,封閉滲漏口。(2)來源於動脈瘤體內肋間動脈的迴流(稱為第II型內滲漏),該型內滲漏大部分可行封閉,不需要手術治療。
2、 剝離遠端內膜破裂口的處理:
部分胸主動脈剝離動脈瘤患者,不僅有近端的主動脈內膜破裂口,還有遠端的內膜破裂口,此類患者術後再次造影時常發現假腔造影劑濃度下降,而不是完全消失。在傳統開胸主動脈重建術中,對夾層遠端內膜破裂口常不作處理,而只是將近端分隔內膜牢固縫合於剝離外膜。在腔內隔絕術中,對這種情況,目前有兩種觀點:一種認為假腔內血流來自主動脈遠端的逆行血流,血流量大大減少,可不用處理待其自然形成血栓後自行封閉;另一種觀點則認為,遠端破裂口不處理仍有導致剝離破裂的可能,因此需在遠端放置另一植入物封閉遠端內膜破裂口,但剝離遠端常侵犯至腹腔幹、上腸系膜、腎動脈等重要分支,行腔內隔絕術難度較大。
3、 腔內內套膜支架術中癱瘓的預防:
傳統胸部降主動脈重建術的一個典型併發症是術後癱瘓,發生率約10%.腔內內套膜支架手術亦具有同樣的危險。因同樣可能影響脊髓動脈血液供應,脊髓血液供應成節段性,胸腰段脊髓的血液供應主要來源於相對應之肋間動脈及腰椎動脈後分支所形成的脊髓前動脈,其中根最大動脈(Arteria Radicularis Magna),是脊髓前動脈的主要滋養血管,保留它可避免癱瘓。但該動脈的起源位置不固定,發自左側第六肋間動脈至第十二肋間動脈的機率是75%,源自於上三個腰椎動脈之一的機率是15%,起源於胸六以上肋間動脈的機率較小。故在行腔內內套膜支架治療胸主動脈夾層動脈瘤時,植入物選擇應選用能完全隔絕夾層內膜破口的最短長度,移植物遠端儘量不超過第六胸椎,避免覆蓋三對以上肋間動脈或腰椎動脈,必要時還應行脊髓液測壓和減壓處理,以降低截癱發生率。
4、 主動脈瘤腔內內套膜支架術後併發症:
主動脈瘤腔內內套膜支架術後短期內患者會出現:一過性C-反應蛋白升高,發熱(常見於術後第二天起,午後發熱,體溫一般不超過38.5°C),紅血球、白血球、及血小板輕度下降(一般無需輸血治療)等表現。體檢時無感染症狀,因原因不明故暫且稱之為主動脈瘤腔內內套膜支架術後併發症。可能的原因為植入物的異物反應、瘤腔內血栓形成後的吸收、植入物對血球的機械性破壞等。給予腎上腺皮質激素及消炎鎮痛類藥物即可緩解。
五、胸主動脈剝離動脈瘤的其他腔內治療方法
腔內內套膜支架治療胸主動脈剝離動脈瘤只有不足20年的歷史,而經腔內行胸主動脈剝離隔膜開窗術則已經有了近70年的歷史。該手術的目的在於緩解夾層隔膜引起的遠端動脈缺血併發症,而非治療胸主動脈剝離動脈瘤本身。其設計思想是經剝離隔膜遠端開窗,使主動脈血流流經剝離假腔,經遠端隔膜破裂口回流至剝離真腔,以緩解剝離隔膜引起的剝離遠端急性缺血,同時重要臟器缺血的挽救有助於降低急性期胸主動脈剝離動脈瘤的死亡率。該手術方式因療效不確實而從未得以推廣,但70年來也始終有作者未放棄該手術方式的研究。因術後通暢率不佳,故過去多數作者提倡以下肢動脈解剖位置外繞道手術(如股-股、腋-股旁路等)或腎動脈重建術等取代該術式。近期腔內剝離隔膜開窗術也有了新的進展,內膜開窗後可經汽球擴張再置入血管腔內支架[13-15],有作者報導以此手術術方式治療有威脅生命的剝離遠端缺血併發症患者40例,手術成功率在90%以上,但術後短期患者死亡率為25%.由此可見,該手術方式或許可作為剝離急性期挽救急性缺血肢體或臟器的選擇之一,但由於未能解決剝離動脈瘤壁薄弱的問題而絕非首選方法。
六、胸主動脈剝離動脈瘤腔內內套膜支架治療的前景
胸主動脈剝離動脈瘤腔內內套膜支架手術問世不足20年,其簡捷微創、安全有效的特點已經吸引了大量的血管外科醫生和胸主動脈剝離動脈瘤患者,在世界範圍內得到較為廣泛的開展。從臨床資料分析,腔內內套膜支架治療慢性期Stanford B型胸主動脈剝離動脈瘤已經積累了較大的病例數,手術成功率各單位均可達到90%以上,術後最長達3年的追蹤亦證實其療效,所以可以作為治療慢性期Stanford B型胸主動脈剝離動脈瘤的常規手術。對Stanford A型和急性期B型胸主動脈剝離動脈瘤的腔內內套膜支架手術治療,因病例數較少,目前尚有爭論,但隨著腔內內套膜支架手術器械的改進和手術醫師臨床經驗的積累,這可能成為腔內內套膜支架治療胸主動脈剝離動脈瘤的新方向。
七、胸主動脈剝離及胸主動脈瘤治療成果
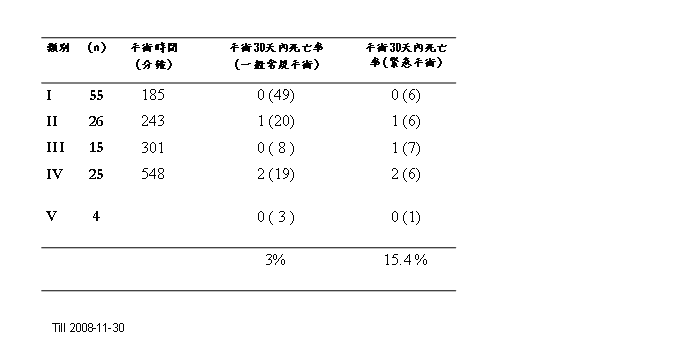
以台北榮總為例目前胸主動脈瘤受惠於腔內微創術式佔所有病患的65%,其中包含各式各樣的主動脈疾病。其中又以主動脈剝離的病患為主共佔64%。一般常規手術30天內死亡率約為3%;而因破裂需緊急手術的病患共佔21%,30天內死亡率則由傳統手術 的50%以上降為15.4 %。[16-18]
八 主動脈剝離及胸主動脈瘤混合型手術 [16-18]
胸部主動脈瘤常因必須處理侵範範圍廣泛的病灶外,必須同時面對再次鋸開胸骨及大範圍的胸腹手術部位。所以手術不但依然深具挑戰性且危險性亦居高不下。胸腔支架血管縱然對於不同類型的主動脈病變治療已證明相當有效,然而對應用於治療升主動脈及主動脈弓部位時,主要的局限為缺乏適當地支架血管近端附著部位,因而無法穩固地固定進而衍生出滲漏、位移及長期耐用性問題,必需加以解決。而近年來不但於技術上屢屢創新,突破並改良傳統大範圍手術方式,進一步由單純的降主動脈支架血管置入治療,發展至今的五大類術式 (見表二、圖六)。
第一大類單純的支架血管微創治療降主動脈病變,傷口最小(只有鼠蹊部約三公分傷口),效果最佳(手術死亡率<1%),恢復快速,然而僅佔所有微創術式的41%。 另外第二至第五大類共59%則必須合併部份傳統術式,稱之為混合型微創手術。例如第二類需混合傳統頸部繞道手術,手術30天內死亡率約3%。 第三及第四類的混合胸部的重建腦部循環的手術,手術死亡率約10%左右,及第五類需混合腹部(Vischeral)血管繞道手術, 手術死亡率約3~5%。 相較於傳統術式主動脈弓的手術死亡率25%,降主動脈5~15%及胸腹主動脈20~76%的高風險皆呈現明顯的下降。(見表三、四)
其中混合胸部繞道技術更進一步改良為二:不需心肺機輔助,升主動脈束帶(Banding)支架血管得以穩固附著(Landing) (圖七);以及需心肺機輔助降溫以象鼻術式置換主動脈弓,支架血管置入象鼻人工血管內穩固附著(圖八)。不但傷口變小,手術時間降低,手術風險性由20-30%降至5%。
表二:五大類手術方式(見)
|
類別
|
術式
|
|
第一大類
|
單純的支架血管微創治療降主動脈病變
|
|
第二大類
|
需混合傳統頸部繞道手術
|
|
第三大類
|
不需心肺機輔助混合胸部的重建腦部循環的手術
|
|
第四大類
|
需心肺機輔助混合胸部的重建腦部循環的手術
|
|
第五大類
|
需混合腹部(Vischeral)血管繞道手術
|

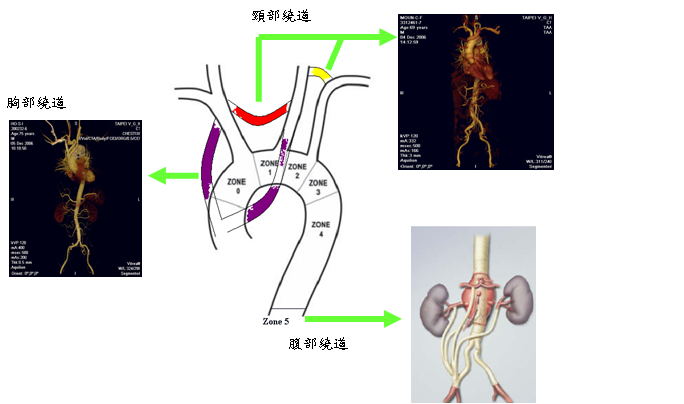
圖六、本技術的創新歸納成五大類術式包含只需以支架血管微創治療方式,以及混合頸部繞道,胸部繞道,或腹部繞道以重建腦部或腹部臟器血循的混合術式。
表三:五大類手術方式
經由這些技術的創新,不但克服了支架血管微創治療所擔心的滲漏、位移及長期耐用性問題,希望更進一步改良治療胸、腹主動脈瘤的微創方式成為「有效」、「簡捷」而又「安全」的常規新技術。
圖七、白箭頭:升主動脈束帶(Banding)支架血管得以穩固附著(Landing)

圖八、象鼻術式置換主動脈弓,支架血管置入象鼻人工血管內穩固附著
參考文獻
1. Parodi JC et al. Transfemoral intraluminal graft implantation for abdominal aortic aneurysms. Ann Vasc Surg 1991;5:491-499.
2. Shih CC, Chen CC, J Chang, CM Shi et al. Endovascular aortic graft exclusion of abdominal aortic aneurysm Chinese Medical Journal (Taipei) 2001;64:661-666
3. Svensson LG, Crawford ES. Cardiovascular and vascular disease of the aorta. W. B. Saunders Company. 1997. 42
4. Dake MD, Kato N, Mitchell RS, et al. Endovascular stent-graft placement for the treatment of acute aortic dissection. N-Engl-J-Med. 1999 ; 340(20): 1546-1552.
5. Slonim SM, Miller DC, Mitchell RS, et al. Percutaneous balloon fenestration and stenting for life-threatening ischemic complications in patients with acute aortic dissection. J-Thorac-Cardiovasc-Surg. 1999; 117(6): 1118-1126
6. Prinssen M, Verhoeven EL, Buth J, Cuypers PW, van Sambeek MR, Balm R, Buskens E, Grobbee DE, and Blankensteijn JD: A randomized trial comparing conventional and endovascular repair of abdominal aortic aneurysms. N Engl J Med 2004, 351: 1607-1618.
7. Greenhalgh RM, Brown LC, Kwong GP, Powell JT, Thompson SG. Comparison of endovascular aneurysm repair with open repair in patients with abdominal aortic aneurysm (EVAR trial 1), 30-day operative mortality results: randomised controlled trial. Lancet 2004;364:843-848.
8. Kouchoukos NT, Dougenis D (1997) Surgery of the thoracic aorta. N Engl J Med 336:1876–1888.
9. Cooley, DA. Surgical Management of aortic dissection Tex Heart Inst J. 1990; 17(4): 289–301.
10. DeBakey ME,McCollum CH, Crawford ES, Morris GC Jr, Howell J, Noon GP, Lawrie G. Dissection and dissecting aneurysms of the aorta: twenty-year follow-up of five hundred twenty-seven patients treated surgically Surgery. 1982 Dec;92(6):1118-1134.
11. Crawford ES, DeNatale RW. Thoracoabdominal aortic aneurysm: observations regarding the natural course of the disease. J Vasc Surg1986;3:578-82.
12. Svensson LG, Crawford ES, Hess KR, Coselli JS, Safi HJ. Experience with 1509 patients undergoing thoracoabdominal aortic operations. J Vasc Surg 1993;17:357-68; discussion 368-70.
13. Dake MD, Kato N, Mitchell RS, Semba CP, Razavi MK, Shimono T, Hirano T, Takeda K, Yada I, and Miller DC: Endovascular stent-graft placement for the treatment of acute aortic dissection. N Engl J Med 1999, 340: 1546-1552.
14. Nienaber CA, Fattori R, Lund G, Dieckmann C, Wolf W, von Kodolitsch Y, Nicolas V, and Pierangeli A: Nonsurgical reconstruction of thoracic aortic dissection by stent-graft placement. N Engl J Med 1999, 340: 1539-1545
15. RS Mitchell, MD Dake, CP Semba, TJ Fogarty, CK Endovascular Stent Graft Repair of Thoracic Aortic Aneurysms J Thorac Cardiovasc Surg 1996;111:1054-1062.
16. 施俊哲 血管支架簡介 臨床醫學 2008; 62: 454-70.
17. Chen IM, Wu FI, Shih CC*. Banding Technique for Endovascular Repair of Arch Aneurysm with Improper Proximal Landing Zone Circulation Journal 2008;72:1981-1985.
18. Chen IM, Shih CC*. Extending hybrid approach to residual standford type A dissecting aortic aneurysm Interact.Cardiovasc.Thorac.Surg. 2008;7:794
